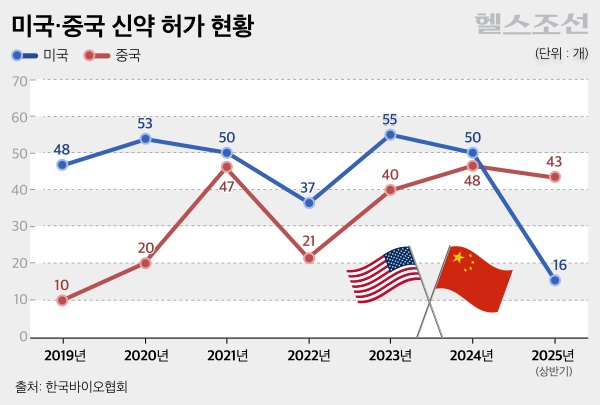
올 상반기 중국의 신약 허가 건수가 전년 대비 크게 늘어난 것으로 나타났다. 반면, 미국은 정부의 예산 삭감과 관련 기관의 구조조정 여파로 인해 허가 건수가 감소했다.
◇중국, 신약 허가 59% 증가… 승인 절차 개선·활발한 임상 등 영향
26일 한국바이오협회에 따르면, 중국 국가약품감독관리국은 지난 23일 중국중앙텔레비전(CCTV)과의 인터뷰에서 올해 상반기 43개의 혁신 신약을 승인했다고 밝혔다. 이는 전년 동기 대비 59% 증가한 수치다.
중국 국가약품감독관리국(NMPA) 의약품등록관리부 양팅 주임은 "올해 상반기 총 43개의 혁신 의약품을 시장에 승인해 전년 동기 대비 59% 증가했다"며 "이는 지난해 중국에서 출시된 전체 48개의 혁신 의약품 수에도 가깝다"고 밝혔다. 이는 미국의 연간 신약 승인 건수가 평균 50건 내외임을 감안할 때 매우 큰 수치다.
중국의 신약 허가 건수 급증은 의약품 심사 승인 절차 개혁에 따른 결과다. 구체적으로는 승인 기준을 개선해 연구 개발 전단~심사 종료까지 혁신 의약품의 출시를 가속화했다.
올해 상반기에 승인된 신약 중 다수는 항암제, 대사·면역질환 등 주요 질병 치료용 의약품이다. 중국 최초의 혈우병 B 유전자 치료제 'BBM-H901'가 승인을 받았고, 면역·대사 질환 치료용 희귀질환 치료제도 승인됐다. 이 외에도 중국 최초의 줄기세포치료제, 신형 항인플루엔자 A 치료제, 희귀질환 치료제 등 사회적으로 우려가 큰 질환의 치료제들도 다수 승인됐다.
활발한 임상 시험과 함께 연구개발(R&D) 파이프라인을 다수 보유하고 있다는 점 또한 신약 허가 급증에 영향을 미친 것으로 풀이된다. 실제 현재 중국의 혁신 신약 연구개발 파이프라인은 전 세계의 약 25%를 차지하고 있으며, 중국 정부는 매년 약 3000개의 임상 연구를 수행하고 있다. 그동안 도시를 기준으로는 서울이 전 세계 임상 시험 건수가 가장 많은 지역이었으나, 이마저도 2023년부터 중국 베이징이 서울을 제친 것으로 알려졌다.
NMPA는 올해 총 70개의 소아 의약품과 21개의 희귀질환 치료제가 승인될 것으로 예상하고 있다. 한국바이오협회 오기환 전무는 "올해 허가 건수가 증가한 점을 고려할 때 증가 추세가 계속 이어질 수 있는 신호로 풀이된다"며 "글로벌 제약사들이 미국 도널드 트럼프 정부의 눈치를 보면서도, 중국의 잠재력을 높게 평가해 중국 기업들과의 협력을 지속하고 있는 상황"이라고 말했다.
◇미국, 16건에 그쳐… FDA 구조조정 등 여파
반대로 미국의 경우 신약 허가 건수가 전년 대비 감소했다. 미국의 올해 상반기 신약 허가 건수는 16건으로, 전년 동기 대비 5건 줄었다.
미국 국립보건원(NIH)·미국 식품의약국(FDA) 등 보건 당국에 대한 정부의 예산 삭감과 구조조정에 따라 승인 심사가 지연됐기 때문이다. 앞서 미국 도널드 트럼프 행정부는 NIH의 내년 예산을 올해보다 40% 삭감한 275억달러(한화 약 38조원)로 편성했다. 미국 의회 입법조사기관인 의회예산처(CBO)는 NIH 예산이 10% 감소하면 임상 1상 시험에 진입할 수 있는 신약 후보물질이 30년간 30개 줄어들고, 시장에 출시되는 신약의 수가 연간 약 4.5% 감소할 것으로 전망했다. CBO는 FDA 신약 허가 심사 기간이 약 9개월 늘어나면 첫 10년간 신약이 3개가 줄고, 두 번째 10년과 세 번째 10년간 각각 10개의 신약이 감소할 것이라고 예측하기도 했다. 현재 FDA는 구조조정의 일환으로 약 3500명의 직원을 해고한 후, 일부 직원을 재고용하는 등 불안정한 모습을 보여주고 있다.
오기환 전무는 "미국의 경우 올해 전체 합산 허가 건수까지 떨어질지 지켜봐야 하나, FDA 인력 구조조정 등으로 인한 여파가 있을 것이라는 시선이 우세하다"고 말했다.
◇중국, 신약 허가 59% 증가… 승인 절차 개선·활발한 임상 등 영향
26일 한국바이오협회에 따르면, 중국 국가약품감독관리국은 지난 23일 중국중앙텔레비전(CCTV)과의 인터뷰에서 올해 상반기 43개의 혁신 신약을 승인했다고 밝혔다. 이는 전년 동기 대비 59% 증가한 수치다.
중국 국가약품감독관리국(NMPA) 의약품등록관리부 양팅 주임은 "올해 상반기 총 43개의 혁신 의약품을 시장에 승인해 전년 동기 대비 59% 증가했다"며 "이는 지난해 중국에서 출시된 전체 48개의 혁신 의약품 수에도 가깝다"고 밝혔다. 이는 미국의 연간 신약 승인 건수가 평균 50건 내외임을 감안할 때 매우 큰 수치다.
중국의 신약 허가 건수 급증은 의약품 심사 승인 절차 개혁에 따른 결과다. 구체적으로는 승인 기준을 개선해 연구 개발 전단~심사 종료까지 혁신 의약품의 출시를 가속화했다.
올해 상반기에 승인된 신약 중 다수는 항암제, 대사·면역질환 등 주요 질병 치료용 의약품이다. 중국 최초의 혈우병 B 유전자 치료제 'BBM-H901'가 승인을 받았고, 면역·대사 질환 치료용 희귀질환 치료제도 승인됐다. 이 외에도 중국 최초의 줄기세포치료제, 신형 항인플루엔자 A 치료제, 희귀질환 치료제 등 사회적으로 우려가 큰 질환의 치료제들도 다수 승인됐다.
활발한 임상 시험과 함께 연구개발(R&D) 파이프라인을 다수 보유하고 있다는 점 또한 신약 허가 급증에 영향을 미친 것으로 풀이된다. 실제 현재 중국의 혁신 신약 연구개발 파이프라인은 전 세계의 약 25%를 차지하고 있으며, 중국 정부는 매년 약 3000개의 임상 연구를 수행하고 있다. 그동안 도시를 기준으로는 서울이 전 세계 임상 시험 건수가 가장 많은 지역이었으나, 이마저도 2023년부터 중국 베이징이 서울을 제친 것으로 알려졌다.
NMPA는 올해 총 70개의 소아 의약품과 21개의 희귀질환 치료제가 승인될 것으로 예상하고 있다. 한국바이오협회 오기환 전무는 "올해 허가 건수가 증가한 점을 고려할 때 증가 추세가 계속 이어질 수 있는 신호로 풀이된다"며 "글로벌 제약사들이 미국 도널드 트럼프 정부의 눈치를 보면서도, 중국의 잠재력을 높게 평가해 중국 기업들과의 협력을 지속하고 있는 상황"이라고 말했다.
◇미국, 16건에 그쳐… FDA 구조조정 등 여파
반대로 미국의 경우 신약 허가 건수가 전년 대비 감소했다. 미국의 올해 상반기 신약 허가 건수는 16건으로, 전년 동기 대비 5건 줄었다.
미국 국립보건원(NIH)·미국 식품의약국(FDA) 등 보건 당국에 대한 정부의 예산 삭감과 구조조정에 따라 승인 심사가 지연됐기 때문이다. 앞서 미국 도널드 트럼프 행정부는 NIH의 내년 예산을 올해보다 40% 삭감한 275억달러(한화 약 38조원)로 편성했다. 미국 의회 입법조사기관인 의회예산처(CBO)는 NIH 예산이 10% 감소하면 임상 1상 시험에 진입할 수 있는 신약 후보물질이 30년간 30개 줄어들고, 시장에 출시되는 신약의 수가 연간 약 4.5% 감소할 것으로 전망했다. CBO는 FDA 신약 허가 심사 기간이 약 9개월 늘어나면 첫 10년간 신약이 3개가 줄고, 두 번째 10년과 세 번째 10년간 각각 10개의 신약이 감소할 것이라고 예측하기도 했다. 현재 FDA는 구조조정의 일환으로 약 3500명의 직원을 해고한 후, 일부 직원을 재고용하는 등 불안정한 모습을 보여주고 있다.
오기환 전무는 "미국의 경우 올해 전체 합산 허가 건수까지 떨어질지 지켜봐야 하나, FDA 인력 구조조정 등으로 인한 여파가 있을 것이라는 시선이 우세하다"고 말했다.