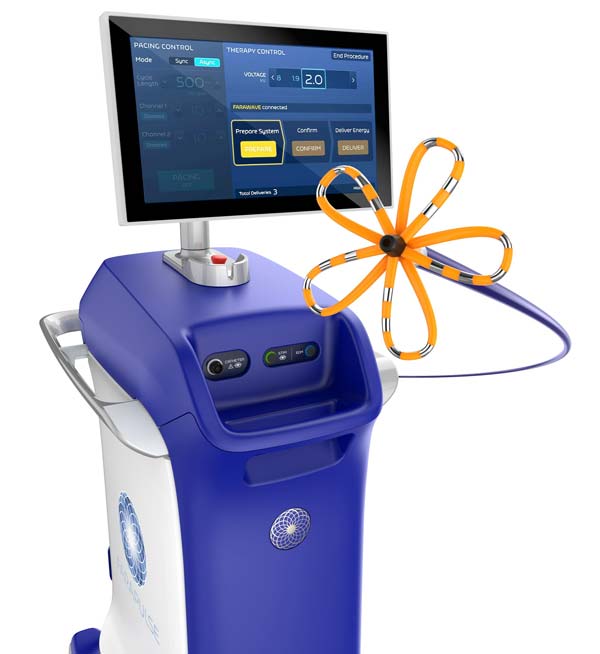
보스턴사이언티픽은 지난 7일(현지 시간) 미국 식품의약국(FDA)으로부터 심방세동 치료 기기 ‘파라펄스’의 적응증 확대 승인을 받았다고 밝혔다.
앞서 파라펄스는 지난해 1월 약물 불응성·재발성·발작성 심방세동 치료 기기로 FDA 승인을 받았다. 이번에 ‘약물에 내성이 있는 환자’까지 적응증을 넓히면서 지속성 심장세동 치료 전반에서 공식 승인됐다.
심방세동은 발작성과 지속성으로 나뉜다. 발작성 심방세동으로 부정맥이 계속되면 지속성 심방세동이 된다. 발작성 심방세동 환자는 심방이 정상적으로 수축하지 못해 혈전 발생을 겪는다. 어지러움, 피로, 호흡 곤란 증상은 물론, 뇌졸중이나 신장경색 위험을 높여 빠른 치료가 필요하다.
기존에 심박세동은 주로 약물치료나 시술치료를 진행했지만, 최근 파라펄스와 같은 ‘펄스장절제술(PFA)’이 도입됐다. 고주파 열에너지나 냉각에너지를 사용하는 기존 시술과 달리 고강도 전자기파를 이용해 심장세포만 타격하고 정상세포에는 영향을 주지 않아 안전한 치료법으로 주목받고 있다.
이번 파라펄스 확대 승인은 올해 발표된 ADVANTAGE 임상을 근거로 한다. 항부정맥제에 내성이 있는 260명의 심방세동 환자를 대상으로 한 연구다. 이 연구에서 파라펄스로 치료받은 환자의 85.3%가 심방세동 재발이 나타나지 않았다. 특히 3회 이상 시술받은 경우에는 이 비율이 91.4%까지 증가했다.
보스턴바이오사이언티픽은 “적응증 확대를 통해 안전성과 효과를 갖춘 절제술로 심방세동 치료 환경을 개선할 것”이라며 “재절제가 필요한 환자, 기저질환이나 심장 구조 이상을 동반한 환자 등 다양한 군으로 대상을 넓혀 새 임상시험을 시작할 예정이다”고 말했다.
한편, 보스턴바이오사이언티픽은 유럽, 일본, 중국 등에서도 파라펄스의 승인을 기다리고 있다. 최근에는 375명의 심방세동 환자를 대상으로 한 글로벌 임상시험 ReMATCH IDE 임상시험도 시작했다.
앞서 파라펄스는 지난해 1월 약물 불응성·재발성·발작성 심방세동 치료 기기로 FDA 승인을 받았다. 이번에 ‘약물에 내성이 있는 환자’까지 적응증을 넓히면서 지속성 심장세동 치료 전반에서 공식 승인됐다.
심방세동은 발작성과 지속성으로 나뉜다. 발작성 심방세동으로 부정맥이 계속되면 지속성 심방세동이 된다. 발작성 심방세동 환자는 심방이 정상적으로 수축하지 못해 혈전 발생을 겪는다. 어지러움, 피로, 호흡 곤란 증상은 물론, 뇌졸중이나 신장경색 위험을 높여 빠른 치료가 필요하다.
기존에 심박세동은 주로 약물치료나 시술치료를 진행했지만, 최근 파라펄스와 같은 ‘펄스장절제술(PFA)’이 도입됐다. 고주파 열에너지나 냉각에너지를 사용하는 기존 시술과 달리 고강도 전자기파를 이용해 심장세포만 타격하고 정상세포에는 영향을 주지 않아 안전한 치료법으로 주목받고 있다.
이번 파라펄스 확대 승인은 올해 발표된 ADVANTAGE 임상을 근거로 한다. 항부정맥제에 내성이 있는 260명의 심방세동 환자를 대상으로 한 연구다. 이 연구에서 파라펄스로 치료받은 환자의 85.3%가 심방세동 재발이 나타나지 않았다. 특히 3회 이상 시술받은 경우에는 이 비율이 91.4%까지 증가했다.
보스턴바이오사이언티픽은 “적응증 확대를 통해 안전성과 효과를 갖춘 절제술로 심방세동 치료 환경을 개선할 것”이라며 “재절제가 필요한 환자, 기저질환이나 심장 구조 이상을 동반한 환자 등 다양한 군으로 대상을 넓혀 새 임상시험을 시작할 예정이다”고 말했다.
한편, 보스턴바이오사이언티픽은 유럽, 일본, 중국 등에서도 파라펄스의 승인을 기다리고 있다. 최근에는 375명의 심방세동 환자를 대상으로 한 글로벌 임상시험 ReMATCH IDE 임상시험도 시작했다.