요즘처럼 신약 개발이 점점 더 어려운 상황에선 ‘개량신약’이 돌파구가 될 수 있다는 고찰이 나왔다. 모든 제약사가 신약 개발을 할 수 없고, 제네릭(복제약) 시장은 포화돼 경쟁력이 없다. 이 가운데 최근 진행 중이던 임상시험이 취소되고, 기술 수출한 신약 개발이 중단되는 등 예상치 못한 상황까지 벌어지고 있다.
19일 이화여대 약학대학원 제약산업학과 김진희 연구원은 ‘한국제약바이오협회 정책보고서’에서 “개량신약은 한국 제약산업이 가진 한계를 극복할 수 있는 제도”라며 “제약사는 신약보다 시간과 비용 투자가 적고, 보건당국은 특허를 회피한 개량신약으로 고가 신약을 대체해 보험재정을 줄이고, 환자는 용법∙용량∙부작용 등이 개선된 약을 쓸 수 있어 좋다”고 말했다.
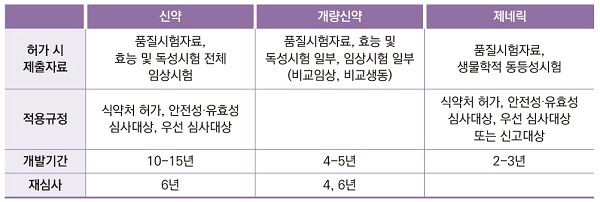
현재까지 국내 개발된 신약은 30개다. 신약은 개발 초기 유효물질을 스크리닝 하는 단계부터 최종 허가를 받아 시판되는 전 과정에 10~15년 정도가 걸린다. 또한 안전성과 유효성을 입증하기 위한 비임상∙임상시험에는 막대한 자본이 필요하다. 지난해 미국에서 임상 1상부터 식품의약국(FDA) 승인까지 걸린 기간은 평균 12.5년으로, 2010년보다 26% 늘어났다.
반면 개량신약은 이미 허가된 의약품에서 안전성∙유효성∙유용성이 개선됐거나 의약기술에 진보성이 있는 약으로, 허가의 많은 부분을 자료제출로 대체할 수 있다. 독성시험 자료와 약리시험 등이 변제돼, 개발 기간이 4~5년으로 짧다.
김진희 연구원은 “2008년 도입된 개량신약은 비교적 적은 연구비용과 짧은 기간으로 성과를 거둘 수 있다”며 “정부는 개량신약에 대한 약가 우대기준으로 여러 차례 도입해왔다”고 말했다.
국내에서 2009~2018년 사이 허가된 개량신약은 총 99개 품목이다. 유형별로는 유효성분의 종류 또는 배합비율 변경, 복합제 등 ‘새로운 조성’ 품목이 52개로 가장 많았다. 그 다음으로는 용법∙용량 개선, 염∙제형 변경 등에 해당하는 ‘새로운 제형’이 26개였다. 이외 ‘새로운 염 또는 이성체로 첫 허가된 의약품’이 6개, ‘명백히 다른 효능∙효과가 추가된 약’이 4개, ‘새로운 투여경로’ 1개 등이었다.
김진희 연구원은 “복합제와 서방정 등의 개발이 많다가 최근에는 한 단계 나아간 ‘새로운 투여 경로’의 개량신약도 나타나고 있다”며 “개량신약은 다국적 제약사에 대응하는 전략이자, 국내 시장 매출 확보, 글로벌 시장 진출에도 용이하다”고 분석했다. 그는 “제약사들이 보다 유용한 기술 개발을 할 수 있도록 보건당국의 적극적 개입과 효과적인 개발 유인책이 필요하다”고 강조했다.